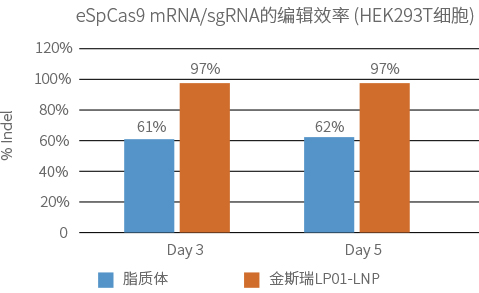
实验方法:
eSpCas9 mRNA和靶向TRAC位点的sgRNA按照1:1的质量比混合,并通过LP01-LNP (2.4 ug of RNA/LNP)和脂质体制剂包装后递送至HEK293T细胞。分别在第3天和第5天裂解细胞,通过PCR和Sanger测序检测编辑效率。
实验结果:
LP01-LNP组的编辑效率可高达97%,远高于脂质体组的编辑效率。

* POI(Point of Interest):实际粒径与理论粒径相差不超过±20 nm
具备完整的IVT mRNA制备流程:从基因合成到LNP包装
| 项目 | 检测方式 | 检测标准 | 研究级 - 标准 | 研究级 – 升级 |
|---|---|---|---|---|
| 外观 | 视觉观测 | 澄清无异物 | ||
| 终浓度 | RiboGreen荧光染料检测 | 0.1 – 0.4 mg/mL | ||
| 包封效率 | RiboGreen荧光染料检测 | > 85% | ||
| 包封RNA的完整性 | 毛细管电泳 | > 75% | ||
| 粒径 | 动态光散射 | POI ±20 nm , 65 - 125 nm | ||
| 多分散系数(PDI) | 动态光散射 | < 0.2 | ||
| Zeta电位 | 激光多普勒电泳 | ± 15.0 mV | ||
| PH | PH试纸/PH计 | 7.4 ± 0.5 | ||
| 内毒素 | 半定量 | < 4EU/ml | ||
| 内毒素 | 定量 | < 4EU/ml | ||
| 生物负载 | 直接接种 | 72小时内不生长 |

实验方法:
eSpCas9 mRNA和靶向TRAC位点的sgRNA按照1:1的质量比混合,并通过LP01-LNP (2.4 ug of RNA/LNP)和脂质体制剂包装后递送至HEK293T细胞。分别在第3天和第5天裂解细胞,通过PCR和Sanger测序检测编辑效率。
实验结果:
LP01-LNP组的编辑效率可高达97%,远高于脂质体组的编辑效率。
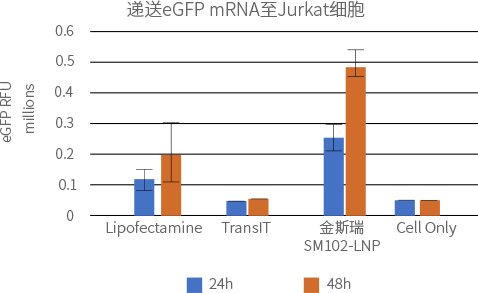
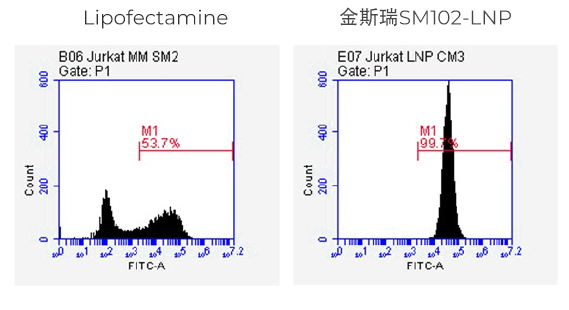
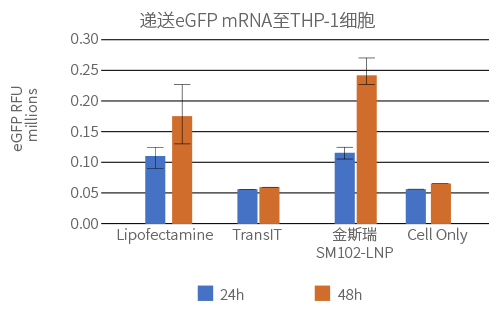
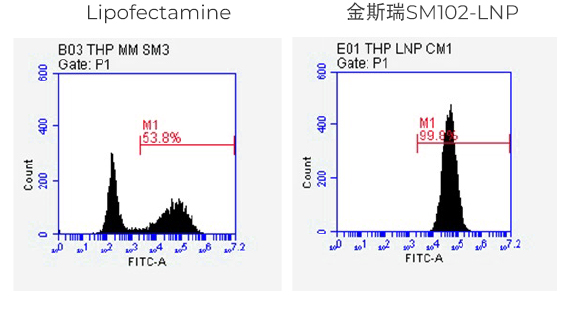
实验方法:
采用脂质体Lipofectamine™ MessengerMAX™ (ThermoFisher)或TransIT® (Mirus)和SM102-LNP 递送100ng或200ng的eGFP mRNA (100% N1-methyl-pseU修饰) ,48小时后用流式细胞仪检测eGFP表达量。
实验结果:
SM102-LNP组的蛋白表达量更高,且表达蛋白的细胞比例更高。
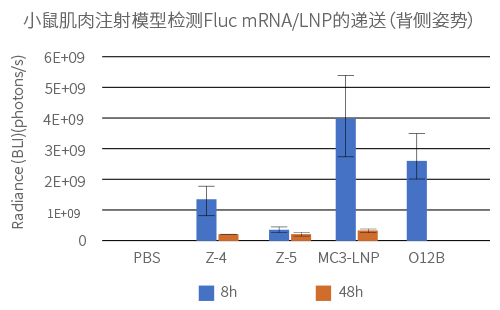
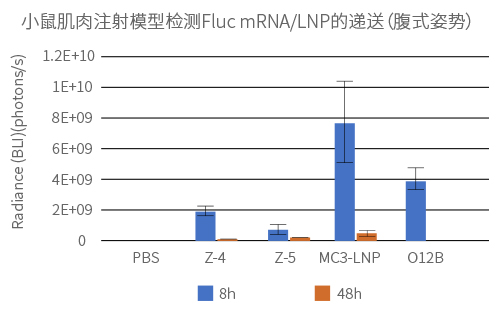
实验方法:
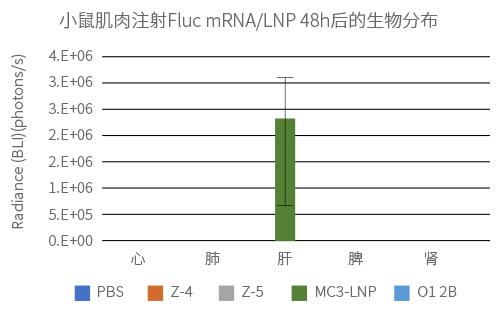
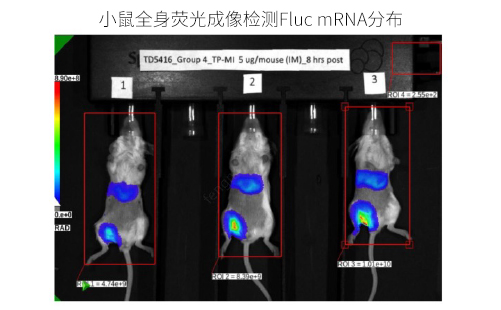
给Balb-C小鼠肌肉注射4种不同LNP制剂包封的Fluc mRNA(100% N1-methyl-pseU 修饰),剂量为0.25mg/kg。通过小鼠全身荧光成像检测Fluc mRNA的表达量和分布。
实验结果:
实验方法:
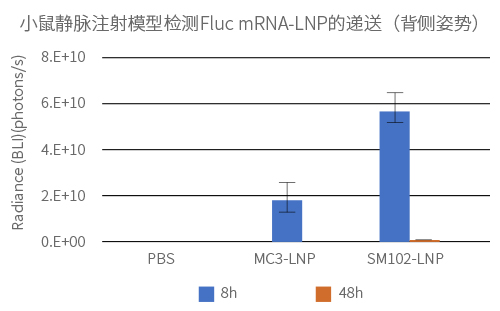
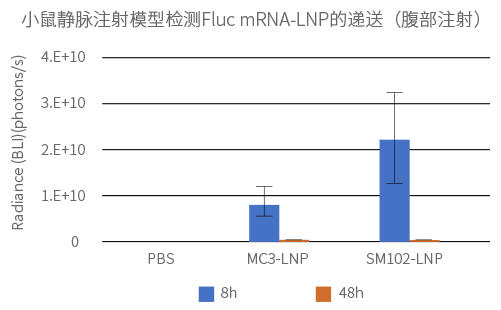
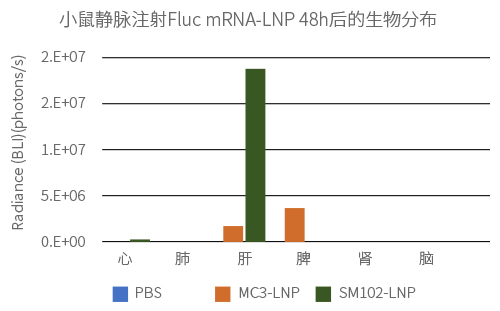
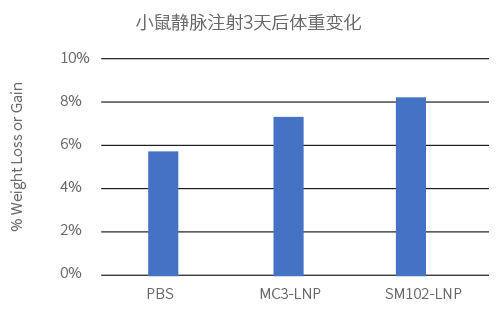
给Balb-C小鼠静脉注射2种不同LNP制剂包封的Fluc mRNA(100% N1-methyl-pseU 修饰),剂量为0.3mg/kg。通过小鼠全身荧光成像检测Fluc mRNA的表达量和分布。
实验结果:
什么是脂质纳米颗粒(LNPs)?
脂质纳米颗粒(LNPs)是可以自组装成球形结构的天然或合成分子。LNPs通常由脂质层组成,形成了一个外壳,内部是可用于输送药物或其他药物的隔离区域。由于其能够保护药物分子不降解并提高其生物利用度的能力,LNPs作为药物输送系统越来越受到关注。
LNPs还可以设计为靶向特定细胞或组织,实现更精确的药物输送。LNPs已被用于各种应用,包括递送基于RNA的治疗剂,如mRNA疫苗。LNPs的脂质层可以与细胞膜融合,使封装的RNA进入细胞并发挥其治疗作用。LNPs也被研究作为其他类型药物(包括小分子和蛋白质)的潜在输送系统。
mRNA LNP如何用于体外细胞转染?



