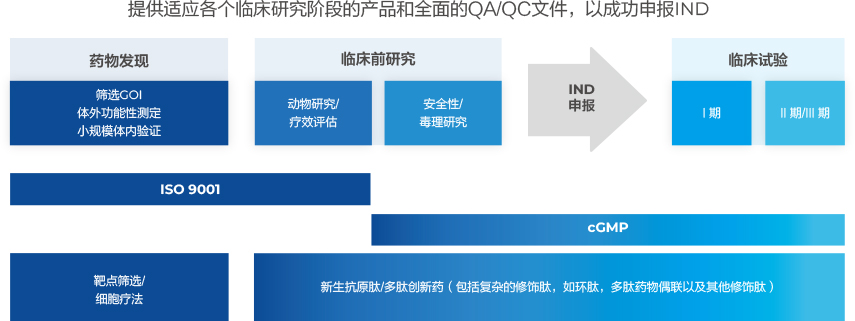
cGMP生产平台聚焦于提供可靠的一站式服务,涵盖了早期的多肽药物开发、IND申报、临床试验。我们为客户量身定制解决方案,满足客户的特殊需求。我们专业的药政事务团队致力于为多肽药物的CMC文件和全球监管策略提供全面支持。
20+年专业经验
cGMP合规性
法规支持

提供满足IND申报的API生产工艺开发的一站式服务
洁净区配备A级无菌隔离器,可以提供无菌多肽
提供适用于新生抗原肽的无菌过滤和无菌灌装服务
提供工艺开发和工艺放大的服务
提供新生抗原肽快速生产、检测、放行服务,最多每个批次48条个性化新生抗原序列
复杂序列和多种多肽修饰可以提供大规模生产服务,包括环肽和多肽药物偶联物。

完整的批生产记录
质量标准包含鉴别 、纯度、微生物限度、内毒素等项目
完善的物料供应商管理体系
分析方法开发、确认、验证服务
符合ICH要求的长期和加速稳定性测试,强降解研究
完善的质量管理系统: 满足ICH Q7A和药品生产质量管理规范
TSE/BSE声明
专业的生产能力,快速交付能力以及平台工艺可以为您解决新生抗原肽以及多肽原料药从早期药物开发到临床I/II期的研究。我们的GMP厂房以及一站式服务,可以灵活支持您各个阶段的研究项目。